Вязка или искусственное осеменение
Определение оптимального момента для вязки Учитывая, что сперматозоиды сохраняют способность к оплодотворению в течение определенного времени (приблизительно 48 часов в гениталиях самки), имеется возможность оптимизировать условия оплодотворения путем синхронизации встречи гамет «в лучшей их форме». Идеальным для вязки или искусственного осеменения следует считать время в течение 48 часов с момента овуляции, чтобы большинство готовых к оплодотворению яйцеклеток и сперматозоидов достигли места встречи (маточные трубы) одновременно. Яйцеклетки с момента их созревания способны к оплодотворению в течение 2 дней (у некоторых пород, вероятно, в течение 2-4 дней), чем объясняется способность собак к оплодотворению двумя разными отцами.
Самая большая трудность при организации вязки заключается в максимально точном определении по биологическим признакам времени начала овуляции.
Если вязку осуществляют рано или поздно, сука рискует остаться «пустой». Тем не менее сука, повязанная за четыре или пять дней до полного созревания яйцеклетки, может быть оплодотворена, так как сперматозоид самца, находящийся в матке, способен существовать в течение нескольких дней, особенно если самец молод и здоров. Были случаи обнаружения живых сперматозоидов в матке более чем через неделю после спаривания. Однако часто после ранней вязки отмечают очень низкую плодовитость самки, вызванную тем, что сперматозоиды к моменту оплодотворения уже не так активны. То есть в этом случае сука Лабрадора может произвести на свет только двух или трех щенков вместо восьми или десяти. При поздних вязках также можно получить небольшой помет, потому что некоторые яйцеклетки в момент вязки, в свою очередь, могут быть подвержены дегенеративным изменениям и остаться неоплодотворенными.
Для определения периода овуляции у течной суки в распоряжении заводчика имеется несколько способов визуальной оценки и дополнительных методов обследования.
• Более светлые выделения из петли в основном свидетельствуют о завершении фазы проэструса, но это не может служить точным индикатором овуляции.
• Вязка, проводимая на 12-й день после первых выделений крови, и ее повторение через два дня — наиболее часто практикуемый метод. Однако только 60-70 % собак эффективно овулируют именно в этот период и, следовательно, могут быть оплодотворенными. В результате значительная часть сук может прохолостеть или принести небольшой помет.
• Благосклонное отношение к самцу и отведение сукой хвоста в сторону не являются точными признаками овуляции. Например, отмечено, что некоторые суки подпускали к себе самцов для вязки в начале проэструса, тогда как сама овуляция наступала только через 30 дней!
Многие суки вступают в вязку в случае ложной течки или инфекционных заболеваний мочевыделительной системы, а также когда секреция эстрогенов в кистах фолликулов ведет к нимфомании.
• Определение электрического сопротивления слизи влагалища с помощью гальванометра позволяет достаточно точно оценить выделение секрета. Показания прибора резко снижаются после овуляции, что свидетельствует о конце периода насыщения эстрогенами и быстром обновлении клеток слизистой влагалища. К сожалению, такой диагностический признак обнаруживается слишком поздно и не может быть использован на практике, ведь гораздо лучше предвидеть скорое наступление овуляции, чем констатировать уже свершившийся факт.
• Реактивные полоски, с помощью которых можно выявить изменение биохимических показателей слизи влагалища, слишком сложно вводить во влагалище на необходимую глубину, избежав при этом контакта с мочой. В целом результаты, получаемые при использовании этого метода, малодостоверны (изменение цвета наблюдается за три дня до овуляции, а также и через три дня после нее).
• Применение влагалищных мазков с использованием соответствующих способов их окраски позволяет отслеживать изменения клеток данного органа, которые связаны с изменениями уровня гормонов (в частности, эстрогенов). Этот простой и недорогостоящий метод широко используют в повседневной практике ветеринарные врачи и заводчики для определения начала фазы полового цикла.
Взятие влагалищного мазка
После обследования набухшей вульвы и оттягивания ее складки вниз вертикально, вдоль задней стенки влагалища вводят тампон так, чтобы он не попал в ямку клитора. Когда тампон достигнет верхнего свода влагалища, ему следует придать горизонтальное положение и продвигать как можно дальше, не прилагая при этом усилий. Затем с помощью круговых движений собирают выделения секрета и отслоившиеся клетки вокруг шейки матки.
В начале течки тампон обычно становится красным, а в конце проэструса он может быть розовым или бесцветным, а также с гноем при инфекционном воспалении влагалища или матки.
Затем кончик тампона аккуратно прокатывают по обезжиренному предметному стеклу, причем для избежания наслоения клеток стараются не попадать дважды на одно и то же место.
После этого нанесенный на предметное стекло материал фиксируют и отправляют к ветеринарному врачу либо окрашивают его для непосредственного исследования.
Анализ мазка
Помимо уточнения сроков овуляции, влагалищные мазки могут применяться и для других целей.
Если от вас сбежала собака, будучи течной, или вы подозреваете, что имела место неже-лательная вязка, то ветеринарный врач определит наличие сперматозоидов (в течение 6 часов после коитуса). Можно также определить риск оплодотворения в зависимости от стадии полового цикла (например, если сука находится в состоянии анэструса, в начале проэструса или в постэстральный период, то возможность оплодотворения минимальна, по крайней мере, есть надежда, что можно будет обойтись без раннего фармакологического абортирования).
С помощью мазков можно контролировать эффективность некоторых методов лечения в фазе анэструса (обычно имеющих противопоказания в период половой активности), например при проведении какой-либо гормональной терапии.
Наконец, мазки используют вместе с методами установления количественного содержания гормонов для диагностики некоторых случаев бесплодия (скрытая течка или отсутствие овуляции, персистенция секретирующего желтого тела, инфицирование влагалища и т. д.).
В связи с простотой и быстротой обследования, а также доступной стоимостью влагалищные мазки широко используют собаководы. Тем не менее в некоторых случаях, когда интерпретация мазков вызывает сомнение, полученные результаты не соответствуют клинической картине, а поездки для проведения вязки или искусственного осеменения недешевы, чтобы совершать их несколько раз, владелец собаки может дополнить этот анализ другим, более точным — по количеству прогестерона в крови.
Количественное определение прогестерона (контроль за овуляцией)
В среднем за пять суток до овуляции концентрация прогестерона в плазме крови начинает увеличиваться по сравнению с его базовой концентрацией (менее 2 нг/мл) и может достичь 40 нг/мл и более. У одних сук концентрация его растет более или менее быстро, у других — медленно, меняясь от цикла к циклу. Лабораторными исследованиями установлено, что в момент овуляции общая концентрация прогестерона достигает средней величины порядка 5-7 нг/мл (15-21 наномоль/литр).
Принято считать, что вязку или искусственное осеменение следует проводить в течение 48 часов с момента овуляции, учитывая при этом время, необходимое для созревания женских половых клеток (48-72 часа). Контрольную вязку осуществляют через два дня после первой.
Такой более или менее точный расчет времени овуляции позволяет повысить не только процент благополучных вязок и осеменения, но также и плодовитость. Дело в том, что малочисленность помета, которую часто приписывают возрасту самки или недостаточному количеству ее созревающих половых клеток, чаще является следствием неправильного выбора даты вязки.
Параллельное использование таких методов, как влагалищные мазки и определение количества прогестерона, дает возможность достаточно подробно и без лишних затрат проследить все этапы течки и тем самым способствовать увеличению количества щенков в помете, а также свести к минимуму дорогостоящие поездки для вязок.
Эхография яичников
Этот метод еще не имеет широкого применения в клинической практике, потому что требует наличия соответствующего оборудования, но он предельно точен. В настоящее время его используют для сук, испытывающих проблемы с плодовитостью или когда возникает риск неблагополучной вязки (пожилая собака, которая должна быть повязана последний раз в ее жизни и т. д.). Ветеринарный врач проводит эхографическое исследование фолликулов, которые увеличиваются день ото дня (таким образом можно получить количественную оценку их роста). В день овуляции вид яичников полностью меняется.
Фолликулы исчезают, и яичники обретают «гладкую» форму, как в фазе полового покоя. Эхографическое исследование надо проводить ежедневно, иначе существует опасность пропустить момент овуляции. При нарушениях плодовитости (малое количество щенков, бесплодие и т. д.) эхографическое исследование дает очень много информации, в том числе имеется возможность подсчета фолликулов, присутствующих в каждом яичнике, и уточнения максимального количества щенков, которое можно получить в помете.
Другие показания для определения уровня прогестерона
•Диагностика бесплодия суки. Прежде чем лечить суку от бесплодия, необходимо, разумеется, найти его причину. Так, с помощью определения уровня прогестерона в крови бесплодной суки в совокупности с другими гормональными анализами и результатами клинического обследования можно понять, идет ли речь об ановуляторном цикле, о рассасывании плодов в результате инволюции желтого тела или о недостаточном половом развитии — для каждого нарушения имеются свои методы лечения. У суки Лабрадора одной из причин бесплодия может быть отсутствие овуляции, что нередко связано с ожирением животного.
•Показания к проведению кесарева сечения. Определив уровень прогестерона, можно установить оптимальный срок проведения кесарева сечения. Если операция проводится преждевременно, то щенки появляются на свет недоношенными и чаще всего погибают от дыхательной недостаточности через несколько часов после рождения, а если, наоборот, слишком поздно, то возникающие у плодов осложнения после долгого нахождения в родовых путях, как правило, приводят к церебральной аноксии. Жизнеспособность плодов зависит от достаточно позднего формирования легочного сюрфактанта, что и определяет дыхательные возможности щенков. Эта физиологическая зрелость органов дыхания совпадает со снижением уровня прогестерона в крови, происходящим накануне оптимальной даты родов. Таким образом, ветеринар имеет возможность легко и точно узнать по количеству прогестерона в крови беременной суки, насколько готовы щенки к рождению, а значит, можно ли проводить кесарево сечение.
Уровень лютеинизирующего гормона
Лютеинизирующий гормон, способный трансформировать клетки фолликула, обеспечивает питание женской половой клетки в желтом теле, вырабатывающем прогестерон. Этот гормон, выделяемый гипофизом, провоцирует овуляцию. Определение его максимальной секреции позволяет достаточно рано распознать овуляцию, а не ее последствия (увеличение содержания прогестерона).
Используемый чаще всего для конкретных показаний при бесплодии, этот метод еще не получил широкого распространения в практической ветеринарии.
Как вяжут собак искусственно
Вязка и искусственное осеменение у собак
В. Фарстад (Wenche Farstad)
Осмотр сук и кобелей следует проводить за 3 недели перед вязкой. Кобель, от которого в предыдущую вязку родились здоровые щенки, не нуждается в подтверждении фертильности. Однако если с момента последней фертильной вязки прошло более года или возраст производителя превышает 7 лет, рекомендуется все же его обследовать. Клиническое обследование должно включать в себя оценку общего состояния здоровья, анализ семенной жидкости, осмотр пениса и препуция и пальпацию простаты, семенников и придатков семенников. У сук оценивают общее состояние здоровья, убеждаются в том, что проведены вакцинации и дегельминтизация. Осмотр наружных половых органов включает инспекцию влагалища и преддверия влагалища на наличие стриктуры, стеноза или сохранения гимена. Для вычисления оптимальных сроков вязки проводят исследование вагинальных выделений и/или тест на концентрацию прогестерона.
ПСИХОЛОГИЧЕСКИЕ АСПЕКТЫ ВЯЗКИ
Перед проведением искусственного осеменения (ИО) — в случае вероятных проблем при вязке — как владелец животного, так и ветеринарный врач должны учесть психологические и физиологические механизмы нормальной вязки. Тем более что психологию взаимоотношений во время вязки понимают далеко не все заводчики. Для вязки суку доставляют к производителю, а не наоборот; соблюдение этого условия особенно важно в случае, если речь идет о первой вязке молодого кобеля. Желательно, чтобы пару молодому кобелю составляла опытная сука, и наоборот — партнером для неопытной суки был выбран зрелый кобель.
Между кобелем и сукой складываются определенные взаимоотношения, возникает симпатия или, наоборот, неприязнь, которая может привести к тому, что кто-то из партнеров откажется от коитуса. Социальный статус кобеля или суки и фактор доминирования также способны создавать проблемы. Молодой самец, занимающий подчиненное положение, в обществе доминирующей суки испытывает робость, которая оборачивается трудностями при попытке совершить садку или интромиссию. Доминирующая сука даже в период эструса может подавлять такого партнера, вынуждая его отказаться от вязки, зато охотно спарится с кобелем, занимающим доминирующее положение. Поскольку существуют проблемы, причины которых выходят за рамки физиологии, целесообразно рассмотреть некоторые психологические факторы.
ПРОЯВЛЕНИЯ ПОЛОВОГО ПОВЕДЕНИЯ У СУК
Часто признаки приближения течки становятся заметны за несколько недель до наступления проэструса. Сука заигрывает или делает садку на других собак — как на кобелей, так и на сук. У нее снижается или, наоборот, повышается аппетит, она начинает чаще мочиться, проявляет непослушание, хуже ведет себя во время дрессировки. Для опытного заводчика такое поведение является сигналом, что приближается течка.
В период проэструса у суки повышается интерес к общению с другими собаками. Но на приближение кобеля она реагирует пассивно, может даже укусить и отогнать его, если он попытается ее обнюхать. В конце проэструса поведение меняется. Сука становится игривой, проявляет инициативу в общении с самцами, позволяет им обнюхивать себя. Начало эструса отмечается характерным поведением, например, сука стоит, помахивая хвостом, и отводит его в сторону. Некоторые суки при обнюхивании самцом приподнимают круп, демонстрируя вульву. Когда кобель кладет лапу на спину суки, она прогибается (лордоз) и может сама заигрывать с ним (толкать носом, класть лапу на спину, имитировать садку), если он по какой-то причине проявляет робость. Во время вязки сука стоит спокойно, широко расставив задние лапы, приподняв круп и отведя в сторону хвост.
ПРОЯВЛЕНИЯ ПОЛОВОГО ПОВЕДЕНИЯ У КОБЕЛЕЙ
Молодые кобели демонстрируют садку с самого раннего возраста (с 4–5 недель), это считается нормой. Такая активность важна для кобеля и является тренировкой полового поведения. Кроме того, садка на других собак или неодушевленные предметы способствует половому созреванию. Однако подобное поведение необходимо решительно пресекать, если оно направлено на людей, а особенно на детей.
Феромоны, содержащиеся в вагинальных выделениях и моче течной суки, привлекают кобелей даже на значительном расстоянии и побуждают их следовать за ней. При совместном содержании кобель зачастую даже отказываться от пищи и воды, если у суки течка. На это время его лучше удалить. Некоторые кобели проявляют склонность к голосовому выражению возбуждения и воют без устали целыми днями. Другие пытаются убежать от хозяев, выбив с этой целью дверь или окно, сделав подкоп или перепрыгнув через изгородь; на пресечение таких попыток они нередко отвечают деструктивным поведением. У кобелей, страдающих заболеваниями предстательной железы (например, кистозной гиперплазией), наблюдаются кровянистые выделения из пениса, объясняющиеся разрывом из-за возбуждения, заполненных кровью кист.
Поведение кобеля и принимаемые им позы при встрече с течной сукой обычно свидетельствуют об игривом настроении с примесью опасения, последнее напрямую зависит от социального статуса кобеля. Он приближается к суке, помахивая хвостом, насторожив уши, избегает смотреть на нее пристально. Если она позволяет ему приблизиться, кобель вылизывает ей уши и морду, обнюхивает ее, кладет ей на спину лапу или голову. Если сука не проявляет дружелюбия, кобель может начать игру, дабы усыпить ее бдительность, — он припадает к земле или предлагает суке догнать его.
Состоит из 6 этапов:
2. Кобель совершает активные движения и интромиссию — начальная эрекция.
3. Эрекция — набухание головки полового члена — отделение первой фракции эякулята (прозрачный секрет предстательной железы).
4. Эякуляция — отделение второй фракции (белая, содержащая сперму жидкость) — ротация.
5. Замок — продвижение спермы — отделение третьей фракции (прозрачный секрет предстательной железы).
6. Разрыв замка и окончание вязки.
Если сука подпускает кобеля (фиг. 9.1), он обхватывает ее круп передними лапами и совершает характерные движения. Неопытный кобель обычно контролирует свои движения, пытаясь сориентировать пенис и обнаружить вульву суки. Начальная эрекция обеспечивает интромиссию с помощью кости полового члена. При контакте с вульвой движения кобеля активизируются.
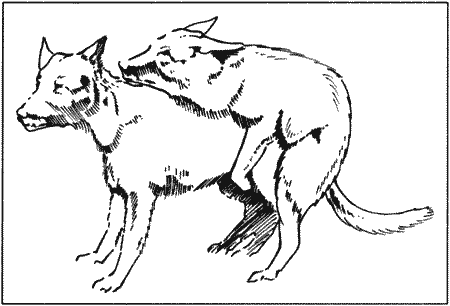
После введения пениса в вульву движения кобеля становятся более активными и энергичными. Он переступает с ноги на ногу (приплясывает), слегка приподнявшись над сукой.
Эрекция и набухание головки полового члена
За время этой стадии достигается полная эрекция. Происходит удлинение головки полового члена, луковица остается закрепленной на кости пениса, тогда как pars longa glandis перемещается вперед поверх кости полового члена. Луковица набухает, обеспечивая сцепление пениса с влагалищем суки (замок). Звуки, издаваемые течной сукой, и ее запах стимулируют эрекцию, которая возникает благодаря импульсам, поступающим из возбуждающих (тазовых внутренностных) нервов, состоящих из парасимпатических волокон таза и крестцовых нервов. Нервные импульсы обеспечивают расширение наружных и внутренних срамных артерий, ведущих к пещеристым телам пениса; сокращение седалищноуретральных мышц предотвращает отток венозной крови. Кровь задерживается в синусах пещеристой ткани луковицы, вызывая ее набухание. Сокращение седалищно-кавернозной и луковично-губчатой мышц, а также констрикция вульвы во время замка поддерживают интенсивность эрекции. В ходе этой фазы выделяется первая фракция эякулята (1–2 мл прозрачного секрета простаты).
Эякуляция и ротация
По достижении полной эрекции происходит отделение второй фракции, содержащей сперматозоиды (1–2 мл). Этот процесс занимает 1–2 минуты. Эякуляция происходит в результате стимуляции нервных окончаний пениса. Сперма с секретом предстательной железы выбрасывается благодаря сокращениям мускулатуры, окружающей уретру, в частности, бульбокавернозной и седалищнокавернозной мышц. Как правило, на этой стадии самец прекращает активные движения, что совпадает с началом эякуляции.
Самец поднимает одну лапу и поворачивается вокруг своей оси, принимая положение «хвост к хвосту» (фиг. 9.2), при этом головка пениса остается в первоначальном положении. Эластичный участок пениса, расположенный позади головки, обеспечивает разворот на 180 градусов. Разворот не причиняет животному дискомфорта, поскольку кость полового члена препятствует обтурации уретры во время эрекции и разворота. Согласно существующему предположению ротация вызывает окклюзию главной вены пениса и тем самым предотвращает прекращение эрекции. Некоторые кобели не совершают разворота, другие остаются в положении садки, что может причинять суке определенные неудобства, особенно если самец отличается крупными размерами; в таких случаях его осторожно приподнимают, облегчая положение самки.
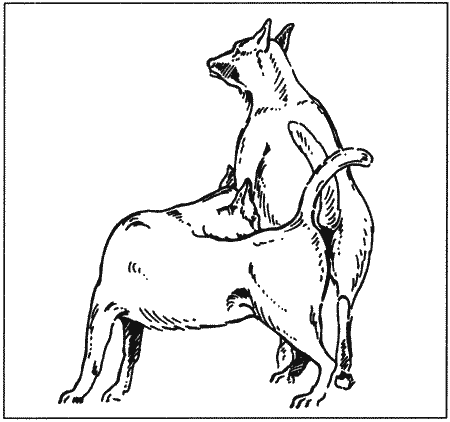
Во время замка кобель обычно стоит спокойно в положении «хвост к хвосту» (фиг. 9.3). На данной стадии происходит эякуляция третьей фракции семенной жидкости (5–20 мл секрета предстательной железы). Одновременно с движениями хвоста происходят ритмичные сокращения перинеальной мускулатуры.
Замок продолжается от 10 до 45 минут, однако автор статьи наблюдал замок, длившийся не менее часа. Насколько можно судить, продолжительность замка не оказывает влияния на результаты вязки. Оплодотворение происходит и при отсутствии замка, после эякуляции второй фракции эякулята, содержащей сперматозоиды, т. е. после окончания самцом толчкообразных движений. Существует предположение, что отсутствие замка сказывается на численности помета, однако, по наблюдениям автора, такое мнение ошибочно.
Во время вязки (садки, интромиссии и замка) опытные суки стоят спокойно. В некоторых случаях сука может попытаться уйти, увлекая за собой кобеля. Обычно такое поведение не причиняет вреда животным, однако разумнее придерживать суку за ошейник, предотвращая подобную попытку.
Перед разъединением эрекция головки полового члена спадает, и партнеры расходятся. Обычно самец вылизывает пенис, который после этого втягивается в препуций. Если между отверстием препуция и пенисом оказалась шерсть или туда попала кожа внешнего слоя препуция, вызывая болезненные ощущения, самцу оказывают помощь. Полная ретракция пениса достигается нажатием на препуций в 2–3 см позади отверстия входа, вызывающим раскрытие отверстия.
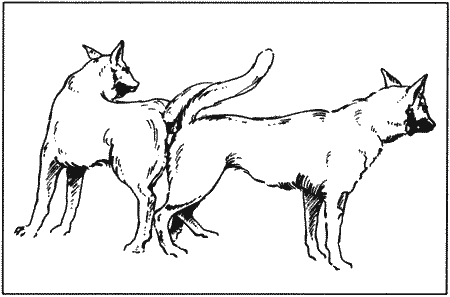
После вязки сука обычно энергично вылизывает влагалище, удаляя вытекшую сперму. Некоторые самки могут демонстрировать возбуждение, прыгать и играть или кататься по земле. Останавливать животное или не позволять ему мочиться нецелесообразно, поскольку во время замка большая часть эякулята уже попала в матку и маточные трубы.
Несмотря на то, что сука подпускает кобеля и позволяет ему совершить садку, при некорректном выборе сроков вязки могут наблюдаться трудности, обусловленные значительным отеком влагалища. Кобель не в состоянии ввести пенис достаточно глубоко, в результате достичь замка не удается. Часто повторная попытка, предпринятая на следующий день, оказывается вполне успешной. Если животные молодые и неопытные, то кобелю следует оказать помощь: поддерживая его за круп, направляют пенис во влагалище.
Некоторые суки, обычно спокойные и мирные, могут паниковать во время интромиссии, проявлять агрессию по отношению к самцу и даже пытаться укусить владельца. В некоторых случаях целесообразно применение транквилизаторов или проведение искусственного осеменения, хотя в последнем случае следует принимать во внимание существующие в Kennel Club правила регистрации щенков, родившихся в результате ИО.
Констрикция кольцевых мышц влагалища, вызванная ригидностью гимена или стриктурой, препятствует полной интромиссии. Сохранение гимена характерно для молодых самок; дефект устраняют, введя палец в перчатке во влагалище. В некоторых случаях может возникать необходимость в хирургическом удалении гимена, однако образование рубцовой ткани может стать источником проблем при родах. Искусственное осеменение является наилучшей альтернативой при стриктуре влагалища или сохранении гимена, если имеющийся просвет позволяет ввести соответствующие инструменты. Опыт автора свидетельствует о том, что вагинальная стриктура подобного типа не вызывает дистоции во время родов.
Отек слизистой оболочки влагалища, наблюдаемый на стадии эструса, может приводить к ее чрезмерному набуханию и пролапсу. Гиперплазия слизистой препятствует совершению коитуса, а часто и введению инструментария для искусственного осеменения. Для лечения назначают вяжущие препараты и дезинфицирующие растворы, при тяжелых поражениях рекомендуется хирургическое удаление гипертрофированной ткани. Неосложненная гиперплазия слизистой влагалища, как правило, регрессирует после окончания эструса, однако у таких животных наблюдается тенденция к рецидивам заболевания в следующую течку. По этой причине сук, склонных к гиперплазии слизистой влагалища, не используют в племенном разведении.
Проблемы, связанные с кобелем
Одной из наиболее распространенных проблем, вызывающих затруднения во время вязки, является неопытность самца. В подобных случаях кобель нередко пытается совершить интромиссию в области анального отверстия или ниже вульвы. Молодые кобели зачастую испытывают перевозбуждение, приводящее к преждевременной эрекции головки пениса, препятствующее интромиссии. На стадии начальной эрекции происходит эякуляция секрета простаты. Эякуляция второй фракции происходит позднее. Необходимо временно разлучить самца с партнершей и дать ему успокоиться, а через 30 минут предпринять вторую попытку. В случае неудачи наилучшим выходом является искусственное осеменение.
В редких случаях молодые кобели неспособны к совершению коитуса из-за фимоза, вызванного адгезией пениса и препуция или стриктурой отверстия препуция. В обоих случаях необходимо хирургическое вмешательство.
Отсутствие либидо у самца может быть обусловлено целым рядом причин, к которым относится неприязнь к половому партнеру, ошибка в выборе сроков вязки, гипоплазия тестикулов, заболевания предстательной железы, мочевые конкременты (редко), баланопостит, эпидидимит, вертебральный артроз (часто встречается у собак таких пород, как датская гончая и пекинес), заболевания нижнего отдела позвоночника (спондилез у боксеров) и задних конечностей (дисплазия тазобедренного сустава). Для выявления причины проводят клиническое обследование. Если либидо снижено из-за психологических проблем, замена партнерши может исправить ситуацию. При сохранении возбуждения самца спаривают с другой самкой или собирают сперму для искусственного осеменения. В тех случаях, когда обнаружены заболевания предстательной железы, мочевые конкременты, эпидидимит и баланопостит, проводят соответствующее лечение. Если проблемы с либидо объясняются наследственными заболеваниями, необходимо обсудить с владельцем этическую сторону вопроса и объяснить, почему животных с генетическими дефектами не используют в племенном разведении.
СБОР И ХРАНЕНИЕ СПЕРМЫ
На основании своего опыта автор считает, что к условиям, обеспечивающим сбор спермы, относятся: присутствие раздражителя — обычно самки, находящейся в состоянии течки (предпочтительнее всего на пике эструса, но если сука будет вести себя спокойно, подойдет любая стадия); отдельное помещение и выход на площадку, на случай, если самец предпочитает предварительно поиграть с самкой; минимальное количество людей. Перечисленные условия благоприятно сказываются на параметрах спермы и значительно облегчают процедуру.
Кобелю дают возможность совершить садку. При выдвижении пениса из препуция оператор отводит последний назад и сдавливают пенис пальцами каудально от головки (фиг. 9.4).
Сбор спермы невозможен до достижения полной эрекции и прекращения толчкообразных движений самца. Для сбора спермы автор использует одноразовую воронкообразную пластиковую чашу. При проведении манипуляции необходимо исключить вероятность травмирования пениса о край сосуда. Такая травма может приводить к разрыву мелких сосудов головки пениса и попаданию крови в эякулят. Особенно склонны к кровотечениям старые собаки. Неизвестно, как присутствие крови сказывается на параметрах спермы, однако ее наличие затрудняет анализ. В идеале образец должен состоять лишь из второй фракции (содержащей сперматозоиды), особенно если сперму предполагается заморозить. При немедленном использовании для искусственного осеменения в пробирку со спермой добавляют 1–2 мл секрета предстательной железы и применяют без дополнительных растворителей.
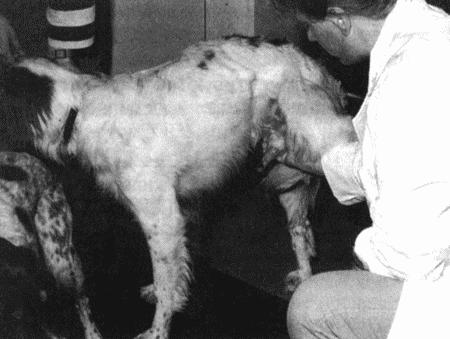
Сбор спермы с использованием течной суки в качестве раздражителя. Оператор отводит препуций, захватывает луковицы в ладонь, а пальцами сжимает основание полового члена позади луковиц. Сперму собирают непосредственно в пластиковую пробирку
При проведении анализа определяют цвет семенной жидкости. Нормальным считают оттенки от молочного до слабо-кремового в зависимости от плотности; желтый оттенок недопустим и указывает на попадание мочи или на воспалительный процесс; красный свидетельствует о присутствии крови. Причину отклонения цвета эякулята от нормы выявляют в ходе микроскопического исследования. Эякулят, содержащий лейкоциты, эритроциты или мочу, центрифугируют при 300–1000 об/мин в течение 5 минут в разбавителе TRIS (табл. 9.1) или растворе с добавлением антибиотиков, супернатант удаляют, а осадок снова разводят в свежем разбавителе, содержащем антибиотики, и используют для искусственного осеменения.
Табл. 9.1. Состав раствора TRIS без глицерина, предназначенный для транспортировки охлажденной спермы
Буферная база содержит антибиотики
Трисгидроксиметиламинометан — 6,056 г;
Лимонная кислота — 3,400 г;
Фруктоза — 2,500 г;
Дистиллированная вода двойной очистки — 200 мл;
Кристаллический пенициллин — 200 000 ЕД;
Дигидрострептомицин — 0,2 г;
Яичный желток вводят непосредственно перед добавлением воды (20 % объема) 2 мл желтка на 8 мл TRIS базы + антибиотики.
Оценку плотности спермы, т. е. концентрации сперматозоидов на единицу объема проводят с использованием счетной камеры и микроскопа или фотометрического счетчика для спермы (фиг. 9.5). Количество сперматозоидов в эякуляте вычисляют исходя из их числа в единице объема и полного объема. Общее количество сперматозоидов в сперме собак варьирует от 200 до 1200 х 10 6 , содержание во второй фракции 100–700 х 10 6 /мл.
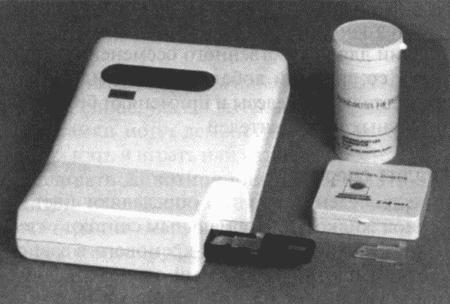
Фотометрический калибратор Spermacue™ для измерения плотности (количества сперматозоидов в мл) свежеполученной неразведеннои спермы собак и лисиц
Прогрессивную подвижность (ПП) оценивают визуально под микроскопом со 100-кратным увеличением. Показатель прогрессивной подвижности (количество сперматозоидов с выраженным поступательным движением) минимально может составлять до 5 % при норме 75–90 % в неразбавленном свежесобранном эякуляте. В замороженной сперме, если ее предполагается использовать для искусственного осеменения, подвижность сперматозоидов после размораживания должна составлять не менее 50 %. Активность сперматозоидов (скорость поступательного движения) также является важным показателем, которому субъективно присваивается значение от 0 до 5, где 0 означает отсутствие прогрессивного движения (некроспермия), а 5 является наивысшим показателем. Нормальная фертильная сперма обычно имеет показатель 3–5; сперма, предназначенная для замораживания, перед заморозкой должна иметь высокие показатели, предпочтительно 5. Низкая температура снижает подвижность сперматозоидов, поэтому для анализа рекомендуется подогревать предметное стекло, в особенности при работе с размороженной спермой. Физиологические растворы, особенно содержащие глицерин, также временно снижают активность сперматозоидов, однако на подогретом предметном стекле она обычно восстанавливается через 2–3 минуты.
В последнее время достаточно широко применяют тест на целостность мембраны и жизнеспособность спермы (гипоосмотический тест). Тест включает инкубацию спермы в гипоосмотической среде, вызывающей набухание хвоста сперматозоида. Этот тест имеет хорошую корреляцию с подвижностью и жизнеспособностью спермы, но не с ее концентрацией.
Морфологический анализ (МА) служит для определения процента сперматозоидов с нормальным внешним видом либо с помощью фазово-контрастной микроскопии при 200-кратном увеличении, либо с использованием менее мощного микроскопа, но тогда с окрашиванием нигрозин-эозином (см. гл. 8). Морфологические показатели считают нормальными, если процентное соотношение морфологически неизмененных сперматозоидов колеблется в пределах от 65 до 90 %. Минимальный процент морфологически нормальных сперматозоидов, при котором сохраняется нормальная фертильность, для собак не установлен, однако показатель ниже 60 % обычно указывает на нарушения функции тестикул или эпидидимиса. У кобелей в период полового созревания до 40 % сперматозоидов могут иметь проксимальные цитоплазматические включения. Сперма, предназначенная для замораживания, должна содержать не менее 75 % морфологически нормальных сперматозоидов.
Показатель целостности акросом особенно важен для морфологической оценки спермы после размораживания. Для подсчета сперматозоидов с неповрежденной акросомой в лаборатории автора применяют окрашивание раствором Spermac™.
Для искусственного осеменения свежесобранной спермой ее разбавлять необязательно. Однако если предполагается транспортировка спермы и использование через 2–3 часа, ее разбавляют специальными разбавителями и транспортируют при температуре 4 ?С, поскольку такие условия способствуют поддержанию жизнеспособности сперматозоидов. Для транспортировки свежесобранной спермы автор с успехом применяет два вида разбавителей (табл. 9.1 и 9.2).
В эксперименте было проведено сравнение разбавителей, содержащих яичный желток, яичный желток в сочетании со сметаной и яичный желток в сочетании с молоком. Для хранения спермы при 4 ?С лучше всего подходит разбавитель TRIS. Во всех растворах желток предохраняет мембрану сперматозоидов от шока, вызываемого воздействием низкой температуры. Разведение спермы обычно проводят в соотношении 1:6 в зависимости от первоначальной концентрации. Важно, чтобы объем раствора превышал объем спермы, и если при сборе сперму не разделяли на фракции, ее центрифугируют и, удалив излишки секрета предстательной железы, смешивают с раствором.
Табл. 9.2. Желточно-сливочный разбавитель для свежеполученной охлажденной спермы
Пастеризованные сливки 12 % жирности — 8 мл;
Яичный желток 20 % от объема — 2 мл.
Охлаждение при транспортировке обеспечивают, помещая образец в термос, частично заполненный колотым льдом. Для перевозки образца используют пластиковые пробирки для центрифуги (например, пробирку на 10 мл с завинчивающейся крышкой для клеточной культуры).
Пробирку с образцом помешают в изолированную колбу, колбу кладут в термос поверх слоя льда и оборачивают бумагой. Перед осеменением сперму постепенно согревают до 30–35 °C.
В литературе имеется подробное описание множества протоколов разведения, замораживания и размораживания спермы. Автор настоящей главы предпочитает работать с разбавителем TRIS, обеспечивающим хороший результат при хранении спермы собак и лисиц. Успешность последующего осеменения составляет 67–80 % при внутриматочном осеменении с использованием спермы с концентрацией 50–150 х 10 6 сперматозоидов в спермодозе и проведением осеменения в два приема с интервалом в 24 часа.
ОБРАБОТКА И ЗАМОРАЖИВАНИЕ СПЕРМЫ СОБАК
Для замораживания к основному раствору TRIS добавляют глицерин и антибиотики (табл. 9.1). Объем добавляемого глицерина составляет от 12 до 16 мл (6 и 8 % общего объема соответственно) в зависимости от техники замораживания: для автоматического замораживания добавляют 6 % глицерина, для ручного — 8 %. В раствор добавляют дистиллированную воду (188 или 184 мл вместо стандартных 200 мл).
В базовый раствор TRIS с глицерином добавляют 20 % яичного желтка. Яичный желток получают от кур, проверенных на отсутствие патогенных факторов (предназначенных на экспорт или домашних). Желток отделяют от белка, выкладывают на лист чистой бумаги, осторожно прокалывают и сливают в воронку и энергично взбивают стеклянной лопаткой, максимально измельчая его частицы, — это позволяет снизить связывание головок сперматозоидов частицами желтка, затрудняющее анализ спермы. Наконец, желток смешивают с буферным раствором TRIS, предварительно подогретым до 30 ?С. Смесь хорошо взбалтывают и нагревают до 35 ?С. Предварительно приготовленный разбавитель можно замораживать и сохранять в таком виде в течение 2 месяцев. Перед применением его размораживают на водяной бане при температуре 35 ?C.
Проводят микроскопическое исследование спермы на соответствие перечисленным выше критериям, затем ко второй фракции эякулята добавляют по каплям подогретый до 35 ?С разбавитель, пока необходимая концентрация не будет достигнута. В лаборатории автора для замораживания обычно используют образцы с общей концентрацией сперматозоидов 100 х 10 6 /мл. Однако при высоком качестве спермы концентрацию можно уменьшить наполовину.
После разбавления несколько капель образца исследуют под микроскопом, а разбавленную сперму сливают в пластиковые центрифужные пробирки, которые помещают в сосуд с водой, подогретой до 35 °C. Затем сосуд переносят в холодильник и оставляют на 2 часа при температуре 4 °C. За это время сперма охлаждается до 4–5 °C, а глицерин, выполняющий роль защитного фактора, проникает в мембрану сперматозоидов.
Сперму вынимают из холодильника, осторожно взбалтывают и немедленно помещают в пластиковые соломины (пайетты) емкостью 0,5 мл. Для выполнения процедуры применяют специальный отсос или насасывают ртом через латексную трубку. При распределении спермы следует проследить за тем, чтобы порошок, находящийся между концами фильтров соломины, пропитался жидкостью и затвердел. Сначала соломины заполняют наполовину, после чего, оставляя пузырек воздуха, доливают, не доводя 1 см до верха. Пузырек воздуха препятствует переливанию спермы (за счет изменения давления при размораживании). После этого соломину запечатывают.
Существуют два альтернативных метода заморозки — ручная (статический протокол) и автоматическая (динамический протокол). Доля глицерина в составе разбавителя зависит от применяемого метода. При ручной заморозке используют контейнер (30 х 40 х 30 см) из полистирола со съемной металлической полкой, помещенной на 10 см ниже края. Контейнер заполняют жидким азотом до уровня, находящегося на 4 см ниже полки.
Заполненные соломки (8–10 максимально) захватывают пинцетом, помещают горизонтально на полку и оставляют в испаряющемся азоте на 8 минут. Затем пинцет охлаждают в жидком азоте, приподнимают и поворачивают с его помощью пайетты, одну за другой, чтобы удостовериться в полной кристаллизации их содержимого. После этого пайетты погружают в жидкий азот. Такую процедуру называют статической в связи с присутствием постоянного нерегулируемого потока испаряющегося азота в период охлаждения и заморозки.
Автоматическая заморозка подразумевает использование машины. Такой способ называют динамическим, поскольку испаряющийся азот поступает в морозильную камеру с различной скоростью в зависимости от заданной программы, позволяющей регулировать темпы заморозки. Программа заморозки осуществляется автоматом Planer 10™, разработанным Hofmo (1988) для замораживания спермы лисиц. В настоящее время этот прибор используется в лаборатории автора, располагающей обширным запасом образцов спермы. Пайетты замораживают в горизонтальном положении на полке со съемной крышкой, причем в морозильной камере может находиться несколько таких полок. Программа заморозки включает следующие режимы:
• -2 ?С/мин. начиная с +4 °C до -7 °C;
• -50 ?С/мин. от -7 °C до -100 °C;
• -25 ?С/мин. от -100 ?С до -180 °C.
после окончания процедуры полку помещают непосредственно в жидкий азот.
Пайеггы размораживают на водяной бане (в термосе) при температуре 70 ?С в течение 8 секунд. После размораживания их ставят вертикально фильтром вниз, распечатывают крышку, встряхивают, чтобы пузырек воздуха мог подняться вверх. Соломку вскрывают и несколько капель образца помещают на подогретое предметное стекло для оценки параметров спермы после размораживания. До восстановления подвижности сперматозоидов проходит некоторое время, обычно 2 минут бывает достаточно. В связи с тем, что разные лаборатории используют различные техники замораживания, при размораживании образца спермы, полученного из какой-то определенной лаборатории, необходимо строго соблюдать все полученные оттуда рекомендации, поскольку процессы замораживания и размораживания тесно связаны между собой.
Практикуется в случаях, если естественная вязка невозможна по ряду причин: кобель и сука живут довольно далеко друг от друга; заводчик намерен осеменить несколько сук или опасается прямого контакта суки с производителем в связи с распространенностью инфекционных заболеваний.
Искусственное осеменение замороженной спермой
Обычно предпринимают, если производитель находится далеко, а отправить свежую сперму не представляется возможным, либо в связи с запретом провозить через границу свежую сперму, либо в случае гибели производителя. В Европе и США существуют банки спермы в национальных собачьих клубах, в научных институтах и в некоторых частных компаниях.
Определение даты осеменения
При наличии свежей спермы процедуру осеменения проводят в день овуляции, а потом через 2 дня повторяют. При использовании замороженной спермы, которая характеризуется сниженной жизнеспособностью, поскольку процессы замораживания и размораживания оказывают негативное воздействие на акросомы и мембраны сперматозоидов, — осеменение осуществляют через 1–2 дня после овуляции, и вторую процедуру проводят через 24 часа после первой. Пробы прогестерона в сыворотке крови служат хорошим индикатором овуляции. Концентрация прогестерона, определяемая радиоиммунным методом, должна поддерживаться на уровне 30 нмоль/л (10 нг/мл) в первый день и между 55 и 75 нмоль/л (18–25 нг/мл) на второй день осеменения. Быстрый иммуноферментный метод (ELISA) определения также подходит для оценки качественного и количественного содержания прогестерона. У лисиц искусственное осеменение позволяет добиваться увеличения численности помета, и при правильном выборе даты оплодотворение наступает в результате одной процедуры.
Свежую сперму вводят во влагалище с помощью жесткого пластикового катетера, применяемого для осеменения коров, но укороченного до нужного размера. Катетер снабжен шприцем на 2–5 мл с резиновым поршнем (фиг. 9.6). Необходимо иметь в виду, что не всякий шприц можно использовать, поскольку некоторые типы резин оказывают токсическое воздействие на сперматозоиды.
Вводимый объем не должен превышать 3 мл для крупных пород и 2 мл для мелких, в противном случае сперма может вытекать из половых путей суки. Вульву приподнимают указательным пальцем и постепенно вводят во влагалище пластиковый катетер. После введения каудальный конец катетера приподнимают и ведут вдоль дорсальной стенки влагалища к своду влагалища для того, чтобы избежать попадания катетера в мочевой пузырь, поскольку отверстие уретры располагается на вентральной стенке влагалища. Второй рукой оператор пальпирует шейку матки через брюшную стенку, корректируя продвижение катетера. Сперму вводят медленно, после чего выдерживают самку в течение 10 минут в положении с приподнятым крупом. Поглаживание области вульвы вызывает сокращения матки, способствующие продвижению спермы.
Для осеменения свежей и замороженно-оттаяной спермой в лаборатории автора разработан специальный внутри маточный катетер (фиг. 9.6), состоящий из нейлоновой направляющей и металлического катетера с прикрепленным шприцем. Техника заключается во введении во влагалище направляющей трубки, с металлическим катетером внутри; после того, как трубка коснется свода влагалища, металлический катетер выдвигают вперед и вводят в шейку матки, придерживая ее большим и указательным пальцем через стенку брюшной полости (фиг. 9.7). Канал шейки прямой с незначительными складками и почти полностью раскрыт на стадии эструса, поэтому введение катетера обычнд не вызывает затруднений. Для выполнения процедуры животное поднимают на стол, седация обычно не требуется (фиг. 9.8). Выполнение манипуляции предполагает наличие определенных навыков, занимает у опытного оператора не более 1–2 минут и не причиняет животному дискомфорта. После выполнения внутриматочного осеменения приподнимать тазовую область суки необязательно.
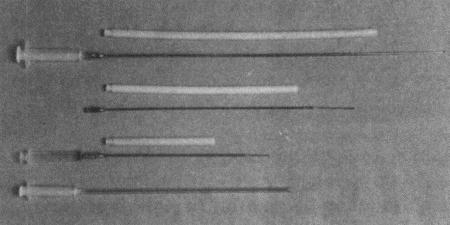
Три различных вида катетеров с нейлоновой направляющей трубкой, используемых для трансцервикального внутриматочного искусственного осеменения собак. Внизу — обычный пластиковый катетер для коров, укороченный до необходимой длины для интравагинального осеменения у собак
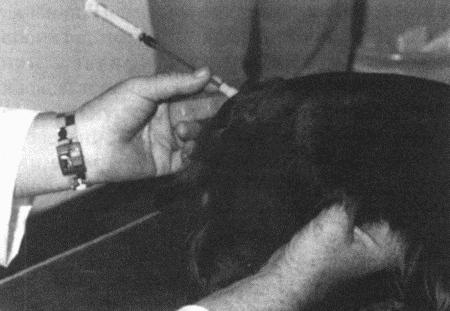
Искусственное осеменение собаки с помощью внутриматочного катетера. Поверх катетера надета пластиковая трубка, предотвращающая контаминацию влагалищной микрофлорой или травму слизистой влагалища металлическим катетером

Трансцервикалъное искусственное осеменение. Животное находится на столе. Седация обычно не требуется, процедура занимает менее 5 мин.
Рекомендуемая доза при внутриматочном осеменении замороженно-оттаявшей спермой составляет 100 х 10 6 сперматозоидов на одно осеменение, однако оплодотворение обеспечивается и меньшим количеством сперматозоидов — 35–40 х 10 6 на одно осеменение при условии корректного выбора даты проведения процедуры и соблюдения технологии размораживания спермы. Доза 100 х 10 6 /мл основана на результатах экспериментов автора со спермой лисиц, в ходе которых важным параметром являлась численность помета. При осеменении в ходе лапаротомии можно ограничиться еще меньшим количеством спермы, однако, насколько известно автору, подобные эксперименты не проводились.
Несмотря на возможность интравагинального осеменения при использовании замороженно-оттаявшей спермы наилучшие результаты обеспечивает внутриматочное осеменение, позволяющее к тому же снизить дозу спермы.
Если катетеризация невозможна или оператор незнаком с техникой ее проведения, рекомендуется искусственное осеменение в ходе лапароскопии или с применением эндоскопа. В США и Канаде хирургические методы искусственного осеменения являются наиболее распространенными. Однако в большинстве европейских стран интравагинальное осеменение, а также техники с применением катетера и эндоскопа считают более этичными.
Andersen К. (1975) Insemination with frozen dog semen based on a new insemination technique. Zuchthygiene 10, 1.
Evans H. E. and deLahunta A. (1971) Miller’s Guide to the Dissection of the Dog. Revised reprint. W. B. Saunders Company, Philadelphia.
Farstad W. (1984a) Bitch fertility after natural mating and after artificialinsemination with fresh or frozen semen. Journal of Small Animal Practice 25, 561–565.
Farstad W. (1984b) The correlation between a cyclus coefficient basedon cytological indices in the vaginal smear and circulating progesterone in oestrous bitches. Zuchthygiene 19, 211–217.
Farstad W. (1992) The optimum time for artificial insemination of blue fox vixens (Alopex lagopus) with frozenthawed semen from silver foxes (Vulpes vulpes). Theriogenology 38, 853–865.
Farstad W. (1996) Semen cryopreservation in dogs and foxes. Proceedings, XIII International Congress on Animal Reproduction and Artificial Insemination, Sydney. Animal Reproductive Science 42, 1–4, 251–260.
Farstad W. and Andersen Berg К. (1989) Factors influencing the success rate of artificial insemination in the dog. Journal of Reproduction and Fertility 39, 289–292.
Hofrno P. O. (1988) Studies on Cr/opreservation of Fox Spermatozoa and Evaluation of the Fertilizing Capacity of Frozen-tha/ved Silver Fox Spermatozoa. PhD thesis, Norwegian College of Veterinary Medicine, Oslo.
Kieffer J. P. (1992) Accouplement dans Tespece canine (mating in thecanine species) In: Les Indispensables l’Animal de Compagnie. Reproduction, ed. С. Dumon and A. Fontbonne, pp. 67–73. P. M. C. A. C, Paris.
Kumi-Diaka J. and Badtram G. (1994) Effect of storage on sperm membrane integrity and other functional characteristics of canine spermatozoa: In vitro bioassay for canine semen. Theriogeno/ogv 366. 41, 1355–1
Laing J. A., Brinley Morgan W. J. and Wagner W. C. (1988) Fertility and Infertility in Veterinary Practice, 4th edn, pp. 10–12. Balliere-Tindall, London.
Linde-Forsberg С. (1995) Artificial insemination with fresh, chilled extended and frozen-thawed semen in the dog. Seminars in Veterinary Medicine and Surgery (Small Animal) 1, 48–58.
Nothling J. O. and Valkman D. H. (1993) Effect of addition of autologous prostatic fluid on the fertility of frozen-thawed dog semen after intravaginal insemination. Journal of Reproduction and Fertility 47, 325–327.
Oettle E. (1986) Using a new acrosome stain to evaluate sperm morphology. Veterinary Medicine 3, 263–266.
Roberts S. J. (197 i)Veteri nary Obstetrics and Genital Diseases (Theriogenology), pp. 609, 620. Edwards Brothers Inc., Ann Arbor Michigan, and Ithaca, New York.
Rodriguez-Gil J. E., Montserrat A. and Rigau T. (1994) Effects of hypoosmotic incubation on acrosome and tail structure on caninespermatozoa. Theriogenology 42, 815–829
Rota A., Strom В. and Linde-Forsberg С. (1995) Effects of seminal plasma and three extenders on canine semen stored at 4?C. Theriogenology 44, 885–887.
Silva L. D. M., Onclin K., Snaps F. and Verstegen J. (1995) Laparoscopic intrauterine insemination in the bitch. Theriogenology 43, 615–623.
Wilson M. (1993) Non-surgical artificial insemination in bitches using frozen semen. Journal of Reproduction and Fertility 47, 307–311.